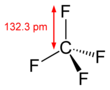Karbon tetraflorür
Karbon tetraflorür veya R-14 olarak da bilinen tetraflorometan, en basit perflorokarbondur (CF4). IUPAC adından da anlaşılacağı gibi, tetraflorometan, hidrokarbon metanın perflorlanmış karşılığıdır. Tetraflorometan kullanışlı bir soğutucudur, lâkin aynı zamanda da güçlü bir sera gazıdır.[3]
| |||

| |||
| Adlandırmalar | |||
|---|---|---|---|
Tetrafluoromethane Carbon tetrafluoride | |||
Diğer adlar Karbon tetraflorür, Perflorometan, Tetraflorokarbon, Freon 14, Halon 14, Arcton 0, CFC 14, PFC 14, R 14, UN 1982 | |||
| Tanımlayıcılar | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.815 | ||
| EC Numarası |
| ||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
| Molekül formülü | CF4 | ||
| Molekül kütlesi | 88.0043 g/mol | ||
| Görünüm | renksiz gaz | ||
| Koku | kokusuz | ||
| Yoğunluk | 3.72 g/L, gas (15 °C) | ||
| Erime noktası | -1.836 °C (-3.273 °F; -1.563 K) | ||
| Kaynama noktası | -1.278 °C (-2.268 °F; -1.005 K) | ||
| Çözünürlük (su içinde) | 0.005%V at 20 °C 0.0038%V at 25 °C | ||
| Çözünürlük | soluble in benzene, chloroform | ||
| Buhar basıncı | 3.65 MPa at 15 °C 106.5 kPa at −127 °C | ||
Henry yasası
sabiti (kH) |
5.15 atm-cu m/mole | ||
| Kırınım dizimi (nD) | 1.0004823[1] | ||
| Akmazlık | 17.32 μPa·s[2] | ||
| Yapı | |||
| Tetragonal | |||
| Tetrahedral | |||
| Dipol momenti | 0 D | ||
| Tehlikeler | |||
| NFPA 704 (yangın karosu) |
|||
| Parlama noktası | yanıcı değil | ||
| Güvenlik bilgi formu (SDS) | ICSC 0575 | ||
| Benzeyen bileşikler | |||
Diğer anyonlar
|
Tetraklorometan Tetrabromometan Tetraiyodometan | ||
Diğer katyonlar
|
Silisyum tetraflorür Germanyum tetraflorür Kalay tetraflorür Kurşun tetraflorür | ||
Benzeyen fluoromethanes
|
Fluoromethane Difluoromethane Fluoroform | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |||
| Bilgi kutusu kaynakları | |||
Tetraflorometan, karbonun kendisi de dâhil olmak üzere herhangi bir karbon bileşiğinin bir flor atmosferinde yakılmasıyla elde edilen üründür. Hidrokarbonlarla, hidrojen florürün bir yan üründür. İlk kez 1926'da üretildiği bildirildi.[4]
Tetraflorometan bazen düşük sıcaklıkta soğutucu (R-14) olarak kullanılır. Elektronik mikro fabrikasyonda tek başına veya silisyum, silisyum dioksit ve silisyum nitrür için bir plazma dağlayıcı olarak oksijenle kombinasyon hâlinde kullanılır.[5]
Kaynakça
değiştir- ^ Abjean, R.; A. Bideau-Mehu; Y. Guern (15 Temmuz 1990). "Refractive index of carbon tetrafluoride (CF4) in the 300-140 nm wavelength range". Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 292 (3): 593-594. Bibcode:1990NIMPA.292..593A. doi:10.1016/0168-9002(90)90178-9.
- ^ Kestin, J.; Ro, S.T.; Wakeham, W.A. (1971). "Reference values of the viscosity of twelve gases at 25°C". Transactions of the Faraday Society. 67: 2308-2313. doi:10.1039/TF9716702308.
- ^ Siegemund, Günter; Schwertfeger, Werner; Feiring, Andrew; Smart, Bruce; Behr, Fred; Vogel, Herward; McKusick, Blaine (2002). "Fluorine Compounds, Organic". Ullmann's Encyclopedia of Industrial Chemistry
- ^ Greenwood & Earnshaw
- ^ K. Williams, K. Gupta, M. Wasilik. Etch Rates for Micromachining Processing – Part II J. Microelectromech. Syst., vol. 12, pp. 761–777, December 2003.