Spermatosit
Spermatositler hayvanlarda bulunan erkek üreme hücreleridir ve olgunlaşmamış üreme hücreleri olan spermatogonyumdan türetilirler. Spermatositler testislerde, özellikle de seminifer tübül[1] adı verilen bir yapı içerisinde bulunur. Primer ve sekonder spermatositler olmak üzere iki tip spermatosit vardır. Birincil ve ikincil spermatositler spermatositogenez ile oluşur.[2]
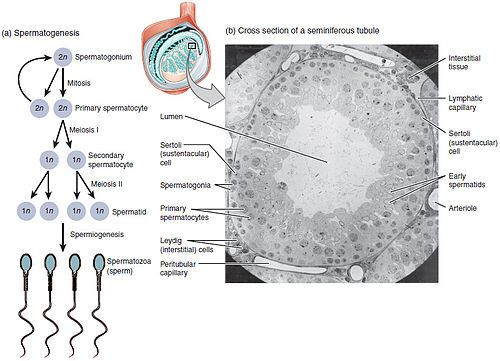
Primer spermatositler diploid (2N) hücrelerdir. Mayoz I'den sonra iki sekonder spermatosit oluşur. İkincil spermatositler, kromozom sayısının yarısını içeren haploid (N) hücrelerdir.[1]
Tüm hayvanlarda, erkekler spermatosit üretir, hatta C. elegans gibi hermafroditler bile erkek veya hermafrodit olarak var olur. Hermafrodit C. elegansta sperm üretimi önce gerçekleşir ve daha sonra spermatheca içinde depolanır. Bir kez yumurta oluştuğunda, kendi kendini dölleyebilir ve 350'ye kadar yavru üretebilir.[3]
Gelişim
değiştirErgenlik döneminde, testis içindeki seminifer tübüllerin duvarları boyunca bulunan spermatogonyum faaliyete geçer ve mitotik olarak bölünmeye başlayarak bir tanesi koyu renkli (Ad) ve diğeri açık renkli (Ap) olmak üzere çekirdek zarına bağlı bir çekirdekçik ile oval bir çekirdek içeren iki tip A hücresi oluşturur. Ad tipi hücreler, seminifer tübüllerin dış bölgesi olan bazal kısımda kalacak olan spermatogonyal hücrelerdir; bu hücreler normalde mitoz geçirmeyen yedek spermatogonyal kök hücrelerdir. Ap tipi hücreler ise aktif olarak bölünen spermatogonyal kök hücrelerdir ve çekirdek zarı ve nükleolus merkezine bağlı yuvarlak çekirdekli ve heterokromatinli B tipi spermatogonyal hücrelere farklılaşmaya başlarlar.[4] B tipi hücreler, adluminal seminifer tübüllerin iç bölgesi olan adluminal kısma göç ederek primer spermatositlere dönüşür. Bu sürecin tamamlanması yaklaşık 16 gün sürer.[2][5]
Adluminal kısımdaki primer spermatositler mayoz I geçirerek sekonder spermatosit adı verilen iki yavru hücreye bölünür. Bu sürecin tamamlanması 24 gün sürer. İkincil spermatositlerin her biri mayoz II'den sonra iki adet spermatid oluşturur.[1]
Mitotik ve mayotik olarak bölünen spermatositler radyasyona ve kansere karşı hassas olsa da, spermatogonyal kök hücreler hassas değildir. Bu nedenle, spermatogonyal kök hücreler radyoterapi veya kemoterapi sonrasında yeniden spermatogenez sürecini başlatabilir.[6]
Hormonların rolü
değiştirİnsanlarda primer spermatositlerin oluşumu, tipik olarak 10-14 yaşları arasında meydana gelen ve erkeklerde cinsel olgunluğun başlangıcını işaret eden ergenlik döneminde başlar. Bu süreç, hipotalamusta gonadotropin salgılatıcı hormonun (GnRH) değişken salınımı ile başlatılır ve bu da ön hipofiz bezi tarafından folikül-uyarıcı hormon (FSH) ve luteinleştirici hormon (LH) salgılanmasına yol açar. FSH'nin testislere salınması, mayoz II'den sonra spermatidlerin olgunlaşmasını kolaylaştıran besleyici hücreler olarak görev yapan Sertoli hücrelerinin gelişimini teşvik eder. LH, Leydig hücrelerini testislere ve kan dolaşımına testosteron salgılamaları için uyarır, böylece spermatogenezi ve sekonder cinsiyet özelliklerinin gelişimini tetikler. Bir erkeğin yaşamı boyunca FSH ve LH salgılanması ölene kadar spermatogenezi uyarmaya devam eder. FSH ve LH seviyelerindeki artış erkeklerde spermatogenez oranını etkilemezken, hormon salgılanma miktarı sabit kalsa bile mayotik profaz sırasında üreme hücrelerinin dejenerasyonundaki artış nedeniyle bireyler yaşlandıkça üretim oranı azalır.[1]
Hücre tipi özeti
değiştirAşağıdaki tablo, tipik olarak DNA replikasyonundan ve G1'deki bölünmeden önce tek bir hücre için ploidi, kopya sayısı ve kromozom/kromatid sayısını göstermektedir. Primer spermatositler DNA sentezinden sonra ve bölünmeden önce arrest olurlar.[1][2]
| Hücre | Tip | Ploidi/İnsan kromozomu | DNA kopya sayısı/İnsanKromatiti | Hücrenin bulunduğu süreç | Süre |
|---|---|---|---|---|---|
| Spermatogonyum (Ad, Ap ve B tipleri) | Üreme hücreleri | Diploid (2N) / 46 | 2C / 46 | Spermatositogenez (mitoz) | 16 gün |
| Primer spermatosit | Erkek gametosit | Diploid (2N) / 46 | 4C / 2x46 | Spermatositogenez (mayoz I) | 24 gün |
| Sekonder spermatosit | Erkek gametosit | Haploid (N) / 23 | 2C / 46 | Spermatidogenez (mayoz II) | Birkaç saat |
| Spermatid | Erkek gametid | Haploid (N) / 23 | 1C / 23 | Spermiyogenez | 24 gün |
| Spermatozoid | Sperm | Haploid (N) / 23 | 1C / 23 | Spermiasyon | 64 gün (toplam) |
Fizyoloji
değiştirHasar, onarım ve arıza
değiştirSpermatositler mayoz bölünmenin profaz aşaması sırasında düzenli olarak çeşitli DNA hasarlarının üstesinden gelir. Bu hasarlar, mayotik rekombinasyonda yer alan Spo11 enzimi ya da oksidatif serbest radikaller nedeniyle DNA'da meydana gelen rastgele kırılmalar sonucu oluşabilir. Bu hasarları onarmak için sırasıyla RAD1 ve γH2AX'ın çift iplik kırıklarını ve kromatini tanıyarak değiştirmede önemli rol oynayan homolog rekombinasyon yolları kullanılır. Mitotik hücrelerin aksine, mayotik hücrelerdeki çift zincir kırılmaları genellikle apoptoza, yani hücre ölümüne yol açmaz.[7] Farelerde, çift iplik kırılmalarının homolog rekombinasyon onarımı spermatogenez süresince gerçekleşir ancak en çok spermatositlerde, özellikle de gen değişiminin baskın onarım türü olduğu mayoz bölünmenin pakiten evresinde belirgindir.[8] Spermatogenezin diğer aşamalarında, karşılıklı değişim tipi onarım daha yaygındır. Özellikle, pakiten spermatositler de dahil olmak üzere fare spermatogenezinin farklı aşamalarındaki mutasyon frekansları somatik hücrelerden 5 ila 10 kat daha düşüktür.[9] Yüksek DNA onarım kapasiteleri nedeniyle, spermatositler olasılıkla bu düşük mutasyon oranlarının sürdürülmesinde ve dolayısıyla erkek germ hattının genetik bütünlüğünün korunmasında merkezi bir rol oynamaktadır.
Erkek üreme hücrelerinin genetik bütünlüğünün korunması, kromozomal yeniden düzenlemelerin oranlarına ve önlenmesine dayanır. Heterozigot yeniden düzenlemelerin sperm üretimini bozabileceği veya durdurabileceği bilinmesine rağmen, bu duruma yol açan moleküler mekanizmalar hala tam olarak anlaşılamamıştır. Bunun muhtemel nedenlerinden biri, spermatositlerde BRCA1, kinaz ATR ve γH2AX varlığını içerebilecek asinaptik bölgelerin kümelenmesiyle ilişkilidir.[10]
Spesifik mutasyonlar
değiştirİnsanlarda mayoz bölünmenin başlaması, retinoik asit sinyal yolu içinde Uyarılan Retinoik Asit 8 (STRA8) geninin varlığına bağlıdır. STRA8 ifadesi, mayoz bölünmede profaz I'in en erken aşaması olan preleptoten spermatositlerde spermatogonyaya kıyasla daha belirgindir. STRA8 mutant spermatositler mayozu başlatabilmelerine rağmen süreci tamamlayamazlar. Leptoten spermatositlerdeki mutasyonlar erken kromozom yoğunlaşmasına yol açabilir.
repro4 mutant spermatositlerinde, mikrotübülle ilişkili bir protein olan Mtap2'deki mutasyonların mayoz I'in profazı sırasında spermatogenezin ilerlemesini durdurduğu gözlenmiştir. Bu durum, repro4 mutantlarında spermatidlerin varlığında azalmayla ortaya çıkmaktadır.[11]
Spermatositlerin Spo11, DMC1, ATM ve MSH5 genlerinde rekombinant-defektif mutasyonlar meydana gelebilir. Bu mutasyonlar çift iplik kırılmalarının onarımını engelleyerek seminifer epitel döngüsünün IV. aşamasında spermatogenezin durmasına neden olur.[12]
Tarihçe
değiştirYıllar boyunca araştırmacılar spermatogenez sürecini incelemiş, üreme ve Sertoli hücreleri gibi iç ya da FSH ve LH gibi dış faktörlere bağlı olarak çeşitli evrelere ayırmışlardır.[13] 1950'lerden 1980'lere kadar, memelilerde hücresel dönüşüm, mitoz ve mayoz da dahil olmak üzere genel spermatogenez sürecinin anlaşılmasında önemli ilerlemeler kaydedilmiştir. Bununla birlikte, 1990'larda ve 2000'lerde, araştırmacılar odaklarını genler, proteinler, sinyal yolları ve ilgili biyokimyasal ve moleküler mekanizmalar yoluyla spermatogenezin düzenlenmesini araştırmaya yöneltmişlerdir. Son yıllarda, erkek kısırlığı daha yaygın hale geldiğinden, çevresel faktörlerin spermatogenez üzerindeki etkisini incelemeye yönelik ilgi artmıştır.[14]
Spermatogenez ile ilgili önemli katkılardan biri memelilerde seminifer epitel döngüsünün keşfedilmesidir. 1952 yılında C.P. Leblound ve Y. Clermont, sıçan seminifer tübülleri üzerinde spermatogoni, spermatosit katmanları ve spermatidleri inceleyen bir araştırma yürütmüştür. Bu çalışma, döngünün farklı aşamalarına ışık tutmuştur. Bir diğer önemli keşif ise 1994 yılında hipotalamik-hipofiz-testis hormon zincirini ve bunun spermatogenezi düzenlemedeki rolünü inceleyen R.M. Sharpe tarafından yapılmıştır.[14]
Diğer hayvanlar
değiştirÖkaryotik hücreler genellikle hayvan gelişiminde çok önemli bir rol oynayan primer siller içerir. Drosophila'da, spermatositlerdeki primer siller farklı özelliklere sahiptir - G2 fazı sırasında bağımsız olarak dört sentriyol tarafından oluşturulurlar ve mikrotübülleri hedef alan ilaçlara karşı hassastırlar. Genellikle, primer siller G0/G1 fazı sırasında bir sentriyolden gelişir ve mikrotübül hedefleyen ilaçlardan etkilenmez.[15]
Bir rabdocoel yassı solucanı olan Mesostoma ehrenbergii, spermatosit oluşumu sırasında erkek mayozuna özgü bir evre sergiler. Anafaz öncesi aşamada, dört univalent kromozom içeren spermatosit hücrelerinde bölünme yarıkları oluşur. Anafaz aşamasının sonunda, bu kromozomlar, mesafe ayrımı olarak adlandırılan bir durum ile fiziksel etkileşim olmaksızın iğ kutupları arasında hareket eder. Bu farklı özellikler, araştırmacıların iğ kutupları tarafından uygulanan kuvveti, bölünme yarığı yönetimini ve mesafe ayrımını incelemelerini sağlar.[16][17]
Ayrıca bakınız
değiştirKaynakça
değiştir- ^ a b c d e Boron, Walter F., MD, Ph.D., Editör; Boulpaep, Emile L. (2012). "54". Medical physiology a cellular and molecular approach. Updated second. Philadelphia: Saunders Elsevier. ISBN 978-1-4377-1753-2.[sayfa belirt]
- ^ a b c Schöni-Affolter, Dubuis-Grieder, Strauch, Franzisk, Christine, Erik Strauch. "Spermatogenesis". 1 Şubat 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Mart 2014.
- ^ Riddle, Donald L., (Ed.) (1997). "I, The Biological Model". C. elegans II. 2nd edition. 2nd (İngilizce). Cold Spring Harbor. NY: Cold Spring Harbor Laboratory Press. 7 Haziran 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Kasım 2014.
- ^ Boitani C, Persio S, Esposito V, Vicini E (5 Mart 2016). "Spermatogonial cells: mouse, monkey and man comparison". Seminars in Cell & Developmental Biology. Cilt 59. ss. 79-88. doi:10.1016/j.semcdb.2016.03.002. ISSN 1096-3634. PMID 26957475. 13 Nisan 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Nisan 2024.
- ^ Y, Clermont (1966). "Renewal of spermatogonia in man". American Journal of Anatomy. 118 (2). ss. 509-524. doi:10.1002/aja.1001180211. PMID 5917196.
- ^ Tres, Abraham L. Kierszenbaum, Laura L. (2012). Histology and cell biology : an introduction to pathology. 3rd. Philadelphia, PA: Saunders. ss. Chapter 20. ISBN 9780323078429. 1 Şubat 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Nisan 2024.
- ^ Matulis S, Handel MA (August 2006). "Spermatocyte responses in vitro to induced DNA damage". Molecular Reproduction and Development. 73 (8). ss. 1061-72. doi:10.1002/mrd.20508. PMID 16700071.
- ^ Srivastava N, Raman MJ (2007). "Homologous recombination-mediated double-strand break repair in mouse testicular extracts and comparison with different germ cell stages". Cell Biochem. Funct. 25 (1). s. 75-86. doi:10.1002/cbf.1375. PMID 16989005. 29 Nisan 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Nisan 2024.
- ^ Walter CA, Intano GW, McCarrey JR, McMahan CA, Walter RB (1998). "Mutation frequency declines during spermatogenesis in young mice but increases in old mice". Proc. Natl. Acad. Sci. U.S.A. 95 (17). ss. 10015-9. doi:10.1073/pnas.95.17.10015. PMC 21453 $2. PMID 9707592. 12 Şubat 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Nisan 2024.
- ^ Sciurano RB, Rahn MI, Rey-Valzacchi G, Coco R, Solari AJ (August 2012). "The role of asynapsis in human spermatocyte failure". International Journal of Andrology. 35 (4). ss. 541-549. doi:10.1111/j.1365-2605.2011.01221.x. PMID 21977946. 29 Nisan 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Nisan 2024.
- ^ Sun F, Handel MA (10 Ocak 2011). "A Mutation in Mtap2 is Associated with Arrest of Mammalian Spermatocytes before the First Meiotic Division". Genes. 2 (1). ss. 21-35. doi:10.3390/genes2010021. PMC 3909985 $2. PMID 24501684. 10 Nisan 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Nisan 2024.
- ^ Barchi M, Mahadevaiah S, Di Giacomo M, Baudat F, de Rooij DG, Burgoyne PS, Jasin M, Keeney S. (August 2005). "Surveillance of Different Recombination Defects in Mouse Spermatocytes Yields Distinct Responses despite Elimination at an Identical Developmental Stage". Molecular and Cellular Biology. 25 (16). ss. 7203-7215. doi:10.1128/MCB.25.16.7203-7215.2005. PMC 1190256 $2. PMID 16055729. 29 Nisan 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Nisan 2024.
- ^ Cheng, C. Yan, (Ed.) (2008). Molecular mechanisms in spermatogenesis (İngilizce). New York: Springer Science+Business Media. ss. Chapter 1, page 1. ISBN 978-0-387-79990-2. 29 Nisan 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Nisan 2024.
- ^ a b Cheng C, Mruk D (19 Nisan 2010). "The biology of spermatogenesis: the past, present and future". Phil. Trans. R. Soc. B. 365 (1546). ss. 1459-1463. doi:10.1098/rstb.2010.0024. PMC 2871927 $2. PMID 20403863. 29 Aralık 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Nisan 2024.
- ^ Riparbelli MG, Cabrera OA, Callaini G, Megraw TL (2013). "Unique properties of Drosophila spermatocyte primary cilia". Biology Open. 2 (11). ss. 1137-47. doi:10.1242/bio.20135355. PMC 3828760 $2. PMID 24244850.
- ^ Ferraro-Gideon J, Hoang C, Forer A (January 2014). "Meiosis-I in Mesostoma ehrenbergii spermatocytes includes distance segregation and inter-polar movements of univalents, and vigorous oscillations of bivalents". Protoplasma. 251 (1). ss. 127-43. doi:10.1007/s00709-013-0532-9. PMID 23921676.
- ^ Ferraro-Gideon J, Hoang C, Forer A (September 2013). "Mesostoma ehrenbergii spermatocytes--a unique and advantageous cell for studying meiosis". Cell Biology International. 37 (9). ss. 892-8. doi:10.1002/cbin.10130. PMID 23686688.