Ondansetron
Diğerlerinin yanı sıra Zofran markası altında satılan ondansetron, kanser kemoterapisi, radyasyon tedavisi, migren veya ameliyatın neden olduğu bulantı ve kusmayı önlemek için kullanılan bir ilaçtır.[9] Gastroenterit tedavisinde de etkilidir.[10][11] Oral (ağız yoluyla), intramüsküler (kas içine enjeksiyon) veya intravenöz (damar içine enjeksiyon) olarak verilebilir.[9]
 | |
 | |
| Klinik verisi | |
|---|---|
| Ticari adlar | Zofran, Atossa,[1][kaynak güvenilir mi?] diğerleri[2] |
| AHFS/Drugs.com | Monografi |
| MedlinePlus | a601209 |
| Lisans veri |
|
| Gebelik kategorisi |
|
| Uygulama yolu | oral olarak (ağız yoluyla), rektal, intravenöz, intramüsküler, ince film |
| ATC kodu | |
| Hukuki durum | |
| Hukuki durum |
|
| Farmakokinetik veri | |
| Biyoyararlanım | ~%60 |
| Protein bağlanma | %70-76 |
| Metabolizma | Karaciğer (CYP3A4, CYP1A2, CYP2D6) |
| Eliminasyon yarı ömrü | 5,7 saat |
| Boşaltım | Böbrek |
| Tanımlayıcılar | |
| |
| CAS Numarası | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Bilgi Paneli (EPA) | |
| ECHA Bilgi Kartı | 100.110.918 |
| Kimyasal ve fiziksel veriler | |
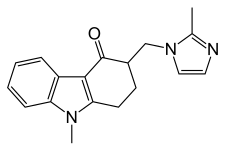
| Formül | C18H19N3O |
| Mol kütlesi | 293,370 g·mol−1 |
| 3D model (JSmol) | |
| |
Yaygın yan etkiler arasında ishal, kabızlık, baş ağrısı, uyku hali ve kaşıntı yer alır.[9] Ciddi yan etkileri arasında QT uzaması ve ciddi alerjik reaksiyon bulunmaktadır.[9] Hamilelik sırasında güvenli gibi görünmektedir ancak bu grupta iyi çalışılmamıştır.[9] Bir serotonin 5-HT3 reseptör antagonistidir.[9] Dopamin reseptörleri veya muskarinik asetilkolin reseptörleri üzerinde herhangi bir etkisi yoktur.[12]
Ondansetron 1984 yılında patentlenmiş ve 1990 yılında tıbbi kullanım için onaylanmıştır.[13] Dünya Sağlık Örgütünün Temel İlaçlar Listesi'nde yer almaktadır.[14] Jenerik bir ilaç olarak mevcuttur.[9] 2021 yılında, 8 milyondan fazla reçete ile Amerika Birleşik Devletleri'nde en sık reçete edilen 79. ilaç olmuştur.[15][16]
Tıbbi kullanımlar
değiştirOndansetron kemoterapiye bağlı bulantı ve kusma ile ameliyat sonrası bulantı ve kusmanın önlenmesinde endikedir.[7][17]
Hamilelik
değiştirOndansetron, gebeliğin sabah bulantılarını ve hiperemezis gravidarumunu tedavi etmek için etiket dışı olarak kullanılır. Genellikle diğer bulantı önleyici ilaçlar başarısız olduktan sonra kullanılır.[18]
Çok merkezli büyük bir kohort çalışmasında, diğer antiemetik ilaçlarla karşılaştırıldığında ondansetron maruziyeti ile fetal risk arasında bir ilişki bulunmamıştır.[19]
Döngüsel kusma sendromu
değiştirOndansetron, döngüsel kusma sendromunun kusma fazı sırasında kullanılan birkaç antiemetik ilaçtan biridir.[20]
Gastroenterit
değiştirAcil servis ortamlarında yapılan çalışmalar, gastroenterit ve dehidrasyonla ilişkili kusma ataklarını sonlandırmak için ondansetron kullanımını desteklemektedir.[21] Muhtemelen viral gastroenteriti olan çocuklarda tek doz oral ondansetron kullanılan randomize kontrollü bir çalışmada, kusmayı durdurmada ve oral rehidrasyon tedavisinin etkinliğini artırmada oldukça etkili olduğu ve böylece hasta memnuniyetini önemli ölçüde artırdığı bulunmuştur. Ondansetron ile tedavi edilen 123 çocuktan sadece 16'sı takip eden 6 saat içinde kusmuştur.[22]
Retrospektif bir inceleme, ondansetronun gastroenterite bağlı kusma için yaygın olarak kullanıldığını ve vakaların %58'inden fazlasında uygulandığını ortaya koymuştur. Kullanımı hastaneye yatışları azaltmış, ancak aynı zamanda acil servise daha yüksek oranlarda geri dönüş ziyaretleri ile ilişkilendirilmiştir. Ayrıca, başlangıçta ondansetron almış olan kişilerin, ilacı almamış olan kişilere kıyasla dönüş ziyaretinde hastaneye kabul edilme olasılığı daha yüksekti. Ancak bu etki, ajanın daha ağır hastalıkla başvuran kişilerde daha sık kullanılmasından kaynaklanıyor olabilir. Kullanımının ciddi tanıları maskelediği tespit edilmemiştir.[23]
İrritabl bağırsak sendromu (IBS)
değiştirİshalli İBS (İBS-D) tanısı konan hastalarda yapılan bir çalışmada ondansetronun dışkı kıvamı, sıklığı, aciliyeti ve şişkinliği üzerinde istatistiksel olarak anlamlı etkileri olduğu, ancak ağrı skorları üzerinde etkisi olmadığı görülmüştür.[24] Bu, daha sonraki bir çalışma ve meta-analizde doğrulanmış[25] ve uluslararası kılavuzlara dahil edilmiştir.[26]
Özel topluluklar
değiştirÇocuklar
değiştirOndansetron 4 yaşın altındaki kişilerde nadiren çalışılmıştır. Bu nedenle, dozaj önerilerine rehberlik edecek çok az veri mevcuttur.[7]
Çeşitli kemoterapi rejimleri alan çocuklarda ondansetronun güvenliğini ve etkinliğini değerlendirmek için karşılaştırmalı olmayan üç açık çalışma yürütülmüştür.
Ondansetron iyi tolere edilmiş ve hiçbir hastada ekstrapiramidal semptomlar görülmemiştir.[27]
Advers etkiler
değiştirBaş ağrısı en yaygın advers etkidir.[7] Ameliyat sonrası bulantı ve kusma için yapılan bir inceleme, tedavi edilen her 36 kişiden birinin şiddetli olabilen baş ağrısı yaşadığını ortaya koymuştur.[28]
Kabızlık, ishal ve baş dönmesi yaygın olarak bildirilen diğer yan etkilerdir. Hepatik sitokrom P450 sistemi tarafından parçalanır ve bu sistem tarafından parçalanan diğer ilaçların metabolizması üzerinde çok az etkisi vardır.[9]
QT uzaması
değiştirOndansetron kullanımı, torsade de pointes olarak bilinen potansiyel olarak ölümcül bir kalp ritmine yol açabilen QT aralığının uzaması ile ilişkilendirilmiştir. Bu durum herhangi bir formülasyona sahip herhangi bir kişide meydana gelebilse de, risk en çok ilacın enjekte edilebilir (intravenöz) formunda belirgindir ve dozla birlikte artar. Risk ayrıca QT aralığını uzatan diğer ilaçları alan kişilerde ve konjenital uzun QT sendromu, konjestif kalp yetmezliği ve/veya bradiaritmisi olan kişilerde daha yüksektir. Bu nedenle, enjekte edilebilir ondansetronun tek dozları tek seferde 16 mg'ı geçmemelidir. (Oral dozaj önerileri, endike olduğunda tek bir 24 mg oral doz önerisi de dahil olmak üzere değişmeden kalır). Enjektabl ondansetron kullanılmadan önce elektrolit dengesizlikleri düzeltilmelidir. Ondansetron alırken düzensiz kalp atışı / çarpıntı, nefes darlığı, baş dönmesi veya bayılma gibi belirtiler ortaya çıkarsa, kişilerin acil tıbbi yardım almaları konusunda uyarılır.[29]
Doz aşımı
değiştirOndansetron doz aşımı için özel bir tedavi mevcut değildir; insanlar destekleyici önlemlerle yönetilir. Ondansetron için bir panzehir bilinmemektedir.[7]
Farmakoloji
değiştirFarmakodinamik
değiştirOndansetron, dopamin reseptörlerine düşük afinitesi olan oldukça seçici bir serotonin 5-HT3 reseptör antagonistidir. 5-HT3 reseptörleri hem periferik olarak vagal sinir terminallerinde hem de merkezi olarak medulladaki area postrema'nın kemoreseptör tetik bölgesinde bulunur. Serotonin, kemoterapötik ajanlara yanıt olarak ince bağırsağın enterokromaffin hücreleri tarafından salınır ve kusma refleksini başlatmak için vagal afferentleri (5-HT3 reseptörleri aracılığıyla) uyarabilir.
Ondansetronun antiemetik etkisinin çoğunlukla vagal afferentlerin antagonizması yoluyla gerçekleştiği ve merkezi reseptörlerin antagonizmasının küçük bir katkısı olduğu düşünülmektedir.[30] R- ve S-ondansetron izomerleri, ex vivo sıçan vagus siniri üzerinde test edildiğinde serotonin antagonistleri olarak benzer güce sahiptir.[31] Bununla birlikte, R-ondansetron enantiyomeri, kobay ileumundan elde edilen uzunlamasına düz kas üzerinde test edildiğinde serotonin ve 2-metil-5-hidroksitriptamin (2-metilserotonin) antagonisti olarak 7,9 kat daha güçlüdür. Bununla birlikte, kobay ileum testi muhtemelen 5-HT3 reseptör antagonizması testi kadar güvenilir değildi, çünkü ondansetron serotoninin etkisini sadece kısmen bloke ederken, 2-metilserotoninin etkisini tamamen bloke etti.[31]
Farmakokinetik
değiştirOndansetron, P-glikoproteine bağlanması ve kan-beyin bariyerinde beyinden dışarı atılması nedeniyle bir dereceye kadar periferik seçiciliğe sahip olabilir.[32][33][34] Ondansetron, R-(-)-ondansetron ve S-(+)-ondansetronun rasemik bir karışımı olarak pazarlanmaktadır ve iki enantiyomerin önemli ölçüde farklı kinetikleri vardır. Her bir enantiyomerden ayrı ayrı 2 mg/kg intravenöz doz verilen sıçanlarda, R-(-)-ondansetronun S-(+)-ondansetrona kıyasla %37 daha uzun bir yarılanma ömrüne (P < 0.05) ve %87 daha yüksek bir eğri altı alana veya EAA'ya (P < 0.01) sahip olduğu bulunmuştur, bu da R enantiyomerinin daha yavaş metabolize olduğunu göstermektedir.[35]
Ondansetron'daki kiral karbon bir karbonil grubuna bitişiktir, bu nedenle keto-enol tautomerizmi, kiral karbon üzerindeki hidrojen çıkarılır ve ardından zıt kiralite ile değiştirilirse teorik olarak fizyolojik koşullar altında iki enantiyomer arasında ara dönüşüme yol açabilir. Her bir enantiyomerin ayrı ayrı verildiği sıçanlarda yapılan bir deney, bu ara dönüşümün hiçbir kanıtını göstermemiştir, kiralite in vivo olarak kararlıdır.[35]
Ameliyat sonrası bulantı ve kusmanın önlenmesi için 4 veya 8 mg intravenöz ondansetron verilen 141 insan hasta üzerinde yapılan bir çalışmada da R ve S-ondansetronun farklı farmakokinetik özelliklere sahip olduğu bulunmuştur. Her hasta karaciğer enzimleri CYP2D6 ve CYP3A5 için genotiplerine göre sınıflandırılmış ve zayıf metabolize ediciler (yavaş) ile ultra metabolize ediciler (hızlı) arasında bir spektruma yerleştirilmiştir. CYP2D6'nın S-ondansetron'un eliminasyonu için daha önemli olduğu, CYP3A5 genotipinin ise ilaç uygulamasından 3 saat sonra ölçülen S-ondansetron plazma seviyeleri üzerinde bir etkisi olmadığı bulunmuştur. CYP3A5, R-ondansetron klirensi için daha önemliydi ve CYP2D6 genotipinin 3. saatte R-ondansetron plazma seviyeleri üzerinde tutarlı bir etkisi yoktu.[36]
Tarihçe
değiştirOndansetron (Zofran markası altında pazarlanmaktadır) 1980'lerin ortalarında Londra'da GlaxoSmithKline tarafından geliştirilmiştir. Eylül 1987'de ABD patent koruması almış,[37] Haziran 1988'de kullanım patenti almış[38] ve Ocak 1991'de ABD'de FDA tarafından onaylanmıştır.[39] Kasım 1996'da bir başka bölümsel patent daha almıştır. Son olarak, GlaxoSmithKline'ın pediatrik kullanım üzerine yaptığı araştırmalar sayesinde ondansetronun patent koruması Aralık 2006'ya kadar uzatılmıştır.[40] Patentinin bu son yılında (2006), Zofran 2006'nın ilk 9 ayında 1.3 milyar ABD$'lık satışla (%80'i ABD'den) ABD'de en çok satan 20. marka ilaç haline gelmiştir.[41] İlk jenerik versiyonlar Aralık 2006'da ABD FDA tarafından onaylanmış ve Teva Pharmaceuticals USA ve SICOR Pharmaceuticals'a pazarlama onayı verilmiştir.[42]
Aralık 2012'de FDA, ondansetronun 32 mg'lık tek intravenöz (IV) dozunun, QT aralığının uzamasından kaynaklanan ciddi kardiyak sorunlara yol açma potansiyeli nedeniyle ABD pazarından çekildiğini duyurmuştur.[43]
2018 yılında São Paulo Üniversitesi ve Biolab'a ilacın orodispersible formu için patent verildi.[44]
Toplum ve kültür
değiştirYayın yanlılığı
değiştir1997 yılında ondansetron bir meta-analiz vaka çalışmasına konu olmuştur. Araştırmacılar 1991 ile Eylül 1996 arasında yayınlanan ve 11.980 kişinin ondansetron aldığı 84 çalışmayı incelemiştir. Plaseboya karşı intravenöz ondansetron 4 mg, 16 raporda ve toplam altı kez tekrarlanan üç raporda araştırılmıştır. Mükerrer olmayan 16 raporda 24 saat içinde kusmayı önlemek için tedavi etmek için gereken sayı (NNT) 9,5 ve %95 güven aralığı 6,9 ila 15 idi. Yinelenen üç raporda, NNT 3,9 (3,3 ila 4,8) ile önemli ölçüde daha düşüktü. Tüm 25 rapor birleştirildiğinde, görünür NNT 4.9'a (4.4 ila 5.6) yükselmiştir. Mükerrer raporların dahil edilmesi ondansetronun antiemetik etkinliğinin %23 oranında fazla tahmin edilmesine yol açmıştır.[45]
Buna ek olarak, yazarlar ondansetron ile ilgili raporların gizlice çoğaltılmasının, makaleler arasında çapraz referanslama yapılmaması nedeniyle tespit edilmesinin kolay olmadığını ve ilaca ilişkin sekiz incelemede mükerrer bulgular içeren raporlara atıfta bulunulduğunu tespit etmişlerdir.[45] Analizleri 1999 yılında Journal of the American Medical Association'da bir başyazı konusu olmuştur.[46]
Kullanılabilirlik
değiştirOndansetron jenerik bir ilaçtır ve birçok ülkede birçok marka adı altında mevcuttur.[2]
Kaynakça
değiştir- ^ "Atossa". MedicinesFAQ. 2022. 28 Ağustos 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Ağustos 2022.
- ^ a b "Ondansetron international". Drugs.com. 2 Eylül 2020. 21 Şubat 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Şubat 2014.
- ^ "Ondansetron Use During Pregnancy". Drugs.com. 3 Ekim 2019. 18 Eylül 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Eylül 2020.
- ^ "Zofran Product and Consumer Medicine Information Licence". TGA eBS. 29 Ağustos 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Ağustos 2022.
- ^ "Zofran Product information". Health Canada. 25 Nisan 2012. 29 Ağustos 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Ağustos 2022.
- ^ "Zofran Tablets 4 mg - Summary of Product Characteristics (SmPC)". (emc). 19 Ocak 2022. 29 Ağustos 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Ağustos 2022.
- ^ a b c d e "Zofran- ondansetron hydrochloride tablet, film coated". DailyMed. 24 Haziran 2020. 6 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Eylül 2020.
- ^ "List of nationally authorised medicinal products : Active substance: ondansetron :Procedure no.: PSUSA/00002217/202102" (PDF). Ema.europa.eu. Erişim tarihi: 5 Mart 2022.
- ^ a b c d e f g h "Ondansetron Hydrochloride". The American Society of Health-System Pharmacists. 3 Mayıs 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Şubat 2017.
- ^ Schnadower D, Finkelstein Y, Freedman SB (January 2015). "Ondansetron and probiotics in the management of pediatric acute gastroenteritis in developed countries". Current Opinion in Gastroenterology. 31 (1): 1-6. doi:10.1097/mog.0000000000000132. PMID 25333367.
- ^ Freedman SB, Ali S, Oleszczuk M, Gouin S, Hartling L (July 2013). "Treatment of acute gastroenteritis in children: an overview of systematic reviews of interventions commonly used in developed countries". Evidence-Based Child Health. 8 (4): 1123-37. doi:10.1002/ebch.1932. PMID 23877938.
- ^ Miloro M, (Ed.) (2012). Peterson's principles of oral and maxillofacial surgery (3. bas.). Shelton, CT: People's Medical Pub. House-USA. s. 86. ISBN 978-1-60795-111-7. 1 Şubat 2016 tarihinde kaynağından arşivlendi.
- ^ FischerJ, Ganellin CR (2006). Analogue-based Drug Discovery. John Wiley & Sons. s. 448. ISBN 9783527607495. 12 Ocak 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Ağustos 2020.
- ^ World Health Organization (2023). The selection and use of essential medicines 2023: web annex A: World Health Organization model list of essential medicines: 23rd list (2023). Cenevre: World Health Organization. hdl:10665/371090. WHO/MHP/HPS/EML/2023.02.
- ^ "The Top 300 of 2021". ClinCalc. 15 Ocak 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Ocak 2024.
- ^ "Ondansetron - Drug Usage Statistics". ClinCalc. 8 Temmuz 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Ocak 2024.
- ^ "Ondansetron hydrochloride injection". DailyMed. 19 Ekim 2022. 8 Temmuz 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Temmuz 2023.
- ^ Smith JA, Refuerzo JS, Ramin SM. "Treatment and outcome of nausea and vomiting of pregnancy". UpToDate. 3 Aralık 2013 tarihinde kaynağından arşivlendi.
- ^ Dormuth CR, Winquist B, Fisher A, ve diğerleri. (April 2021). "Comparison of Pregnancy Outcomes of Patients Treated With Ondansetron vs Alternative Antiemetic Medications in a Multinational, Population-Based Cohort". JAMA Netw Open. 4 (4): e215329. doi:10.1001/jamanetworkopen.2021.5329. PMC 8065380 $2. PMID 33890993.
- ^ Abell TL, Adams KA, Boles RG, Bousvaros A, Chong SK, Fleisher DR, Hasler WL, Hyman PE, Issenman RM, Li BU, Linder SL, Mayer EA, McCallum RW, Olden K, Parkman HP, Rudolph CD, Taché Y, Tarbell S, Vakil N (April 2008). "Cyclic vomiting syndrome in adults" (PDF). Neurogastroenterology and Motility. 20 (4): 269-84. doi:10.1111/j.1365-2982.2008.01113.x. hdl:2027.42/72300. PMID 18371009. 28 Ağustos 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Kasım 2018.
- ^ Freedman SB, Adler M, Seshadri R, Powell EC (April 2006). "Oral ondansetron for gastroenteritis in a pediatric emergency department". The New England Journal of Medicine. 354 (16): 1698-705. doi:10.1056/NEJMoa055119. PMID 16625009.
- ^ Hanif H, Jaffry H, Jamshed F, Amreek F, Kumar N, Hussain W, Rizwan A (September 2019). "Oral Ondansetron versus Domperidone for Acute Gastroenteritis Associated Vomiting in Young Children". Cureus. 11 (9): e5639. doi:10.7759/cureus.5639. PMC 6822884 $2. PMID 31700742.
- ^ Sturm JJ, Hirsh DA, Schweickert A, Massey R, Simon HK (May 2010). "Ondansetron use in the pediatric emergency department and effects on hospitalization and return rates: are we masking alternative diagnoses?". Annals of Emergency Medicine. 55 (5): 415-22. doi:10.1016/j.annemergmed.2009.11.011. PMID 20031265.
- ^ Garsed K, Chernova J, Hastings M, Lam C, Marciani L, Singh G, Henry A, Hall I, Whorwell P, Spiller R (October 2014). "A randomised trial of ondansetron for the treatment of irritable bowel syndrome with diarrhoea". Gut. 63 (10): 1617-1625. doi:10.1136/gutjnl-2013-305989. PMC 4173656 $2. PMID 24334242.
- ^ Gunn D, Topan R, Barnard L, Fried R, Holloway I, Brindle R, Corsetti M, Scott M, Farmer A, Kapur K, Sanders D, Eugenicos M, Trudgill N, Whorwell P, Mclaughlin J, Akbar A, Houghton L, Dinning PG, Aziz Q, Ford AC, Farrin AJ, Spiller R (June 2023). "Randomised, placebo-controlled trial and meta-analysis show benefit of ondansetron for irritable bowel syndrome with diarrhoea: The TRITON trial". Alimentary Pharmacology & Therapeutics. 57 (11): 1258-1271. doi:10.1111/apt.17426. PMID 36866724.
- ^ Savarino E, Zingone F, Barberio B, Marasco G, Akyuz F, Akpinar H, Barboi O, Bodini G, Bor S, Chiarioni G, Cristian G, Corsetti M, Di Sabatino A, Dimitriu AM, Drug V, Dumitrascu DL, Ford AC, Hauser G, Nakov R, Patel N, Pohl D, Sfarti C, Serra J, Simrén M, Suciu A, Tack J, Toruner M, Walters J, Cremon C, Barbara G (July 2022). "Functional bowel disorders with diarrhoea: Clinical guidelines of the United European Gastroenterology and European Society for Neurogastroenterology and Motility". United European Gastroenterology Journal. 10 (6): 556-584. doi:10.1002/ueg2.12259. PMC 9278595 $2. PMID 35695704.
- ^ Stevens RF (1 Ocak 1991). "The role of ondansetron in paediatric patients: a review of three studies". European Journal of Cancer. 27 (Suppl 1): S20-S22. PMID 1831631. 8 Temmuz 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Temmuz 2023.
- ^ Tramèr MR, Reynolds DJ, Moore RA, McQuay HJ (December 1997). "Efficacy, dose-response, and safety of ondansetron in prevention of postoperative nausea and vomiting: a quantitative systematic review of randomized placebo-controlled trials". Anesthesiology. 87 (6): 1277-89. doi:10.1097/00000542-199712000-00004. PMID 9416710.
- ^ "FDA Drug Safety Communication: New information regarding QT prolongation with ondansetron (Zofran)". Food and Drug Administration. 14 Aralık 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Kasım 2012.
- ^ Browning KN (October 2015). "Role of central vagal 5-HT3 receptors in gastrointestinal physiology and pathophysiology". Frontiers in Neuroscience. 9: 413. doi:10.3389/fnins.2015.00413. PMC 4625078 $2. PMID 26578870.
- ^ a b Butler A, Hill JM, Ireland SJ, Jordan CC, Tyers MB (June 1988). "Pharmacological properties of GR38032F, a novel antagonist at 5-HT3 receptors". British Journal of Pharmacology. 94 (2): 397-412. doi:10.1111/j.1476-5381.1988.tb11542.x. PMC 1854010 $2. PMID 2969267.
- ^ Schinkel AH, Wagenaar E, Mol CA, van Deemter L (June 1996). "P-glycoprotein in the blood-brain barrier of mice influences the brain penetration and pharmacological activity of many drugs". Journal of Clinical Investigation. 97 (11): 2517-24. doi:10.1172/JCI118699. PMC 507337 $2. PMID 8647944.
- ^ Kwan C, Bédard D, Frouni I, Gaudette F, Beaudry F, Hamadjida A, Huot P (July 2020). "Pharmacokinetic profile of the selective 5-HT3 receptor antagonist ondansetron in the rat: an original study and a minireview of the behavioural pharmacological literature in the rat". Canadian Journal of Physiology and Pharmacology. 98 (7): 431-440. doi:10.1139/cjpp-2019-0551. PMID 32017606.
- ^ Scott JA, Wood M, Flood P (September 2006). "The pronociceptive effect of ondansetron in the setting of P-glycoprotein inhibition". Anesthesia & Analgesia. 103 (3): 742-6. doi:10.1213/01.ane.0000228861.80314.22. PMID 16931690.
- ^ a b Duan M, Zhao Q, Zhong D, Yuan Y (March 2019). "Pharmacokinetics of R-(-)ondansetron compared with that of S-(-)ondansetron in rats using an LC-MS/MS method". Biomedical Chromatography. 33 (3): e4426. doi:10.1002/bmc.4426. PMID 30408206.
- ^ Stamer UM, Lee EH, Rauers NI, Zhang L, Kleine-Brueggeney M, Fimmers R, Stuber F, Musshoff F (July 2011). "CYP2D6- and CYP3A-dependent enantioselective plasma concentrations of ondansetron in postanesthesia care". Anesthesia and Analgesia. 113 (1): 48-54. doi:10.1213/ANE.0b013e31821d01bc. PMID 21596874.
- ^ US patent 4695578, Coates IH, Bell JA, Humber DC, Ewan GB, "1,2,3,9-tetrahydro-3-imidazol-1-ylmethyl-4H-carbazol-4-ones, composition containing them, and method of using them to treat neuronal 5HT function disturbances", 22 September 1987 tarihinde verildi, assigned to Glaxo Group Limited
- ^ US patent 4753789, Tyers MB, Coates IH, Humber DC, Ewan GB, Bell JA, "Method for treating nausea and vomiting", 28 June 1988 tarihinde verildi, assigned to Glaxo Group Limited
- ^ US patent 5578628, Tyers MB, Coates IH, Humber DC, Ewan GB, Bell JA, "Medicaments for the treatment of nausea and vomiting", 26 November 1996 tarihinde verildi, assigned to Glaxo Group Limited
- ^ "One Year Post-Pediatric Exclusivity Post-marketing Adverse Event Review: Drug Use Data Zofran" (PDF). Memorandum. U.S. Food and Drug Administration. 7 Mart 2006. 24 Eylül 2015 tarihinde kaynağından arşivlendi (PDF).
- ^ IHS.
- ^ "FDA Approves First Generic Ondansetron Tablets, Orally Disintegrating Tablets and Oral Solution" (Basın açıklaması). U.S. Food and Drug Administration. 17 Aralık 2006. 18 Haziran 2014 tarihinde kaynağından arşivlendi.
- ^ "FDA Drug Safety Communication: Updated information on 32 mg intravenous ondansetron (Zofran) dose and pre-mixed ondansetron products". U.S. Food and Drug Administration (FDA). 13 Aralık 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 12 Aralık 2012.
- ^ "Sabia que um remédio para enjoo traz 90% dos royalties que a USP recebe? - Agência USP de Inovação" (Portekizce). 7 Eylül 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ekim 2020.
- ^ a b Tramèr MR, Reynolds DJ, Moore RA, McQuay HJ (September 1997). "Impact of covert duplicate publication on meta-analysis: a case study". BMJ. 315 (7109): 635-40. doi:10.1136/bmj.315.7109.635. PMC 2127450 $2. PMID 9310564.
- ^ Rennie D (November 1999). "Fair conduct and fair reporting of clinical trials". JAMA. 282 (18): 1766-8. doi:10.1001/jama.282.18.1766. PMID 10568651.