Monoamonyum fosfat
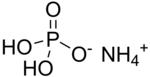
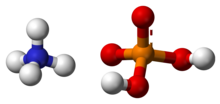
Monoamonyum fosfat (MAP)[5] olarak bilinen amonyum dihidrojen fosfat (ADP), (NH4)(H2PO4) kimyasal formülüne sahip bir kimyasal bileşiktir. MAP tarımsal gübrelerin[6] ve bazı yangın söndürücülerin önemli bir bileşenidir. Optik[7] ve elektronik[8] alanlarında da önemli kullanımları vardır.

| |
| |
| |
| Adlandırmalar | |
|---|---|
Amonyum dihidrojen fosfat | |
Diğer adlar Monoamonyum fosfat | |
| Tanımlayıcılar | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.028.877 |
| EC Numarası |
|
| E numaraları | E342(i) (antioksidanlar, ...) |
PubChem CID
|
|
| UNII | |
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
| Kimyasal formül | H6NO4P |
| Molekül kütlesi | 115,03 g mol−1 |
| Görünüm | beyaz kristaller |
| Koku | yok |
| Yoğunluk | 1.80 g/cm3 |
| Erime noktası | 190 °C |
| Çözünürlük (su içinde) | (g/dL) 28 (10 °C) 36 (20 °C) 44 (30 °C) 56 (40 °C) 66 (50 °C) 81 (60 °C) 99 (70 °C) 118 (80 °C) 173 (100 °C)[2][3] |
| Çözünürlük | etanol ve[2] asetonda çözünmez |
| Kırınım dizimi (nD) | 1.525 |
| Yapı | |
| tetragonal | |
| Termokimya | |
Standart formasyon entalpisi (ΔfH⦵298)
|
−1445.07 kJ/mol[4] |
| Tehlikeler | |
| GHS etiketleme sistemi: | |
| Piktogramlar | 
|
| İşaret sözcüğü | İkaz |
| Tehlike ifadeleri | H319 |
| Önlem ifadeleri | P261, P264, P271, P280, P302+P352, P304+P340, P305+P351+P338, P312, P321, P332+P313, P337+P313, P362, P403+P233, P405, P501 |
| NFPA 704 (yangın karosu) |
|
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz)
|
5750 mg/kg (sıçan, oral) |
| Benzeyen bileşikler | |
Diğer anyonlar
|
Amonyum fosfat Diamonyum fosfat |
Diğer katyonlar
|
Monosodyum fosfat Monopotasyum fosfat |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Kimyasal özellikleri
değiştirMonoamonyum fosfat suda çözünür ve ondan tetragonal sistemde susuz tuz olarak, uzun prizmalar veya iğnelerek olarak kristalleşir.[7] Etanolde pratik olarak çözünmez.[2]
Katı amonyum fosfat pratikte 200 °C'ye kadar olan sıcaklıklarda kararlı kabul edilebilir. Bu sıcaklıktan sonra, gaz halindeki amonyak NH3 ve erimiş fosforik asite H3PO4 ayrışır.[9] 125 °C'de amonyağın kısmi basıncı 0.05 mm Hg'dir.[10]
Stokiyometrik monoamonyum fosfat çözeltisi asidiktir (%0,1 konsantrasyonda pH 4,7, %5'te 4,2).[11]
Üretimi
değiştirMonoamonyum fosfat, doğru miktarda ayarlanmış fosforik asit ve amonyağın ekzotermik reaksiyonuyla endüstriyel olarak üretilir:[12] NH3 + H3PO4 → NH6PO4
Kristal MAP daha sonra çökelir.
Kullanımı
değiştirTarım
değiştirMonoamonyum fosfatın ağırlıkça en büyük kullanımı, gübrelerin bir bileşeni olarak tarımdadır. Toprağı bitkilerin kullanabileceği formda azot ve fosfor elementleriyle besler. NPK etiketi 12-61-0'dır (12-27-0), yani ağırlıkça %12 elementel azot ve (toplam olarak) %61 fosfor pentaoksit P2O5 veya %27 elementel fosfor içerir.
Yangın söndürücüler
değiştirBileşik ayrıca bazı kuru kimyasal yangın söndürücülerdeki ABC tozunun bir bileşenidir.
Optik
değiştirMonoamonyum fosfat, çift kırılma özelliklerinden dolayı optik alanında yaygın olarak kullanılan bir kristaldir. Tetragonal kristal yapısının bir sonucu olarak, bu malzeme, optik dalga boylarında tipik kırılma indisleri no = 1.522 ve ne = 1.478 ile negatif tek eksenli optik simetriye sahiptir.[7]
Elektronik
değiştirMonoamonyum fosfat kristalleri, bazı aktif sonar transdüserlerde (alternatifi, manyetostriksiyon kullanan transdüserlerdir) gerekli bir özellik olan piezoelektrik özelliktedir. 1950'lerde MAP kristalleri, transdüserlerde bulunan kuvars ve Rochelle tuzu kristallerinin büyük ölçüde yerini aldı. Çünkü, kuvarstan daha kolay işleniyorlar ve Rochelle tuzundan farklı olarak havadan nem çekerek sulanmıyorlardı.[8]
Oyuncaklar
değiştirNispeten toksik olmayan MAP, çeşitli renklerde boyalarla karıştırılmış oyuncak kitleri olarak satılan, rekreasyonel kristal yetiştiriciliği için de popüler bir maddedir.
Doğal oluşumu
değiştirBileşik, doğada ender bir mineral olan bifosfamit olarak bulunur. Bifosmamit, guano yatakları içinde oluşur.[13][14] Monohidrojen muadili olan ilgili bir bileşik, daha da az bulunan fosfamittir.[14][15]
Kaynakça
değiştir- ^ Lide, David R. (1998). Handbook of Chemistry and Physics (87 bas.). Boca Raton, Florida: CRC Press. ss. 4-40. ISBN 0-8493-0594-2.
- ^ a b c Dejun Xu, Xing Xiong, Lin Yang, Zhiye Zhang, and Xinlong Wang (2016): "Determination of the Solubility of Ammonium Dihydrogen Phosphate in Water-Ethanol System at Different Temperatures from 283.2 to 343.2 K". Journal of Chemincal Engineering Data, cilt 61, sayı 1, sayfalar 78–82. DOI:10.1021/acs.jced.5b00224
- ^ Chemical Book: "Ammonium dihydrogen phosphate 1 Ocak 2023 tarihinde Wayback Machine sitesinde arşivlendi.". 14-08-2018 tarihinde erişildi.
- ^ National Bureau of Standards. Selected Values of Chemical Thermodynamic Properties. Technical note 270-3. 1968 [1] 1 Ocak 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ "Monoammonium Phosphate (MAP)" (PDF). www.mosaicco.com. 17 Kasım 2015 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 5 Haziran 2015.
- ^ IPNI. "Monoammonium Phosphate (MAP)" (PDF). www.ipni.net. International Plant Nutrition Institute. 24 Eylül 2015 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 21 Haziran 2014.
- ^ a b c Amnon Yariv, Pochi Yeh (1984). Optical Waves in Crystals. Wiley, Inc.
- ^ a b Willem Hackmann (1984). Seek and Strike: Sonar, Anti-Submarine Warfare and the Royal Navy, 1914–1954. Her Majesty's Stationery Office. ISBN 0-11-290423-8.
- ^ G. O. Guerrant and D. E. Brown (196): "Thermal Decomposition of High-Analysis Fertilizers Based on Ammonium Phosphate". Journal of Agricultural and Food Chemistry,cilt 13, sayı 6, sayfalar 493-497. DOI:10.1021/jf60142a002
- ^ John R Van Wazer (1958). Phosphorus And Its Compounds - Volume I: Chemistry. New York: Interscience Publishers, Inc. s. 503.
- ^ Haifa Chemicals Ltd.: "Mono-Ammonium Phosphate 12-61-0 15 Ekim 2022 tarihinde Wayback Machine sitesinde arşivlendi.". Ürün bilgi formu, 02-01-2023 tarihinde erişildi.
- ^ Martin Bäckman, Martin Gunnarsson, Linnea Kollberg, Martin Müller, and Simon Tallvod (2016): "Production of Monoammonium Phosphate at Yara AB 2017-11-18 tarihinde Wayback Machine sitesinde arşivlendi.". Technical Report, Lund University.
- ^ "Biphosphammite". 7 Ocak 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Ocak 2023.
- ^ a b "List of Minerals". 21 Mart 2011. 15 Mart 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Ocak 2023.
- ^ "Phosphammite". 7 Ocak 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Ocak 2023.
