Hidrojen sülfür
Hidrojen sülfür, renksiz, çürük yumurta kokusunda zehirleyici bir gazdır. 1796'da C. Louis Berthallet tarafından bileşiği meydana getiren elementler tâyin edildi. Formülü H2S şeklindedir.
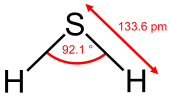
| |
| |

| |
| Adlandırmalar | |
|---|---|
Hidrojen sülfür[1] | |
Diğer adlar Dihidrojen monosülfür Dihidrojen sülfür | |
| Tanımlayıcılar | |
3D model (JSmol)
|
|
| 3DMet | |
| 3535004 | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.029.070 |
| EC Numarası |
|
| 303 | |
| KEGG | |
PubChem CID
|
|
| RTECS numarası |
|
| UN numarası | 1053 |
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
| Kimyasal formül | H2S |
| Molekül kütlesi | 34,08 g mol−1 |
| Görünüm | Renksiz gaz |
| Koku | Çürük yumurta kokusu |
| Yoğunluk | 1,363 g dm−3 |
| Erime noktası | −82 °C (−116 °F; 191 K) |
| Kaynama noktası | −60 °C (−76 °F; 213 K) |
| Çözünürlük (su içinde) | 4 g dm−3 (20 °C) |
| Buhar basıncı | 1740 kPa (21 °C) |
| Asitlik (pKa) | 7.0[2][3] |
| Baziklik (pKb) | 12.9 |
| Tehlikeler | |
| GHS etiketleme sistemi: | |
| R-ibareleri | R12, R26, R50 |
| NFPA 704 (yangın karosu) |
|
| Parlama noktası | −82.4 °C (−116.3 °F; 190.8 K)[5] |
| 232 °C (450 °F; 505 K) | |
| Patlama sınırları | 4.3–46% |
| NIOSH ABD maruz kalma limitleri: | |
| PEL (izin verilen) | C 20 ppm; 50 ppm [10-dakika maksimum zirve] |
| AB sınıflandırması | Şablon:Hazchem F+ Şablon:Hazchem T+ Şablon:Hazchem N |
| Güvenlik bilgi formu (SDS) | Dış MSDS[4] |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Çok şiddetli zehir olan hidrojen sülfürün 10-5'lik bir konsantrasyonda da kokusu hissedilebilir. Sıvılaştırılmış hidrojen sülfür elektriği iletmez. Kaynama noktası -60,75 °C, erime noktası ise -83,70 °C'dir. Havadan 1.19 defâ daha ağırdır. Kaynama noktasında yoğunluğu 0,993'tür. Suda ve alkolde oldukça çözünür. Yanıcıdır ve % 4,5-45,5 oranında hidrojen sülfür içeren hava patlayıcıdır.
Hidrojen sülfür az miktarda petrolde, kaplıcalarda ve tabiî gaz kuyularında bulunur. Elementlerinden de elde edilen hidrojen sülfür laboratuvarlarda demir sülfür üzerine hidrojen klorür etki ettirmekle elde edilir. Saf hidrojen sülfür elde etmek için kalsiyum veya baryum, sülfür reaksiyona sokularak oluşturulur.
2015 yılında, çok yüksek basınç altında (150 GPa (1.5 milyon atm)) hidrojen sülfürün −70 °C'de (203 °K) süper-iletkenlik gösterdiği keşfedildi.[6] Hidrojen sülfür, bugüne kadar bulunmuş en yüksek süper-iletken dönüşüm sıcaklığına sahiptir.
Kaynakça
değiştir- ^ "Hydrogen Sulfide - PubChem Public Chemical Database". The PubChem Project. ABD: National Center for Biotechnology Information. 19 Aralık 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2016.
- ^ Perrin, D.D. (1982). Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution (2.2yayıncı=Pergamon Press bas.). Oxford.
- ^ Bruckenstein, S.; Kolthoff, I.M., in Kolthoff, I.M.; Elving, P.J. Treatise on Analytical Chemistry, Vol. 1, pt. 1; Wiley, NY, 1959, pp. 432–433.
- ^ "Arşivlenmiş kopya". 17 Kasım 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2016.
- ^ "Hydrogen sulfide". npi.gov.au. 30 Mayıs 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2016.
- ^ Cartlidge, Edwin (18 August 2015). "Superconductivity record sparks wave of follow-up physics". Nature News. Retrieved 18 August 2015.
