Çubuk hücreleri
Çubuk hücreleri, gözün retinasında bulunan ve diğer görsel fotoreseptör tipi olan koni hücrelerinden daha düşük ışıkta daha iyi işlev görebilen fotoreseptör hücrelerdir. Çubuklar genellikle retinanın dış kenarlarında konsantre olarak bulunur ve çevresel görüşte kullanılır. Ortalama olarak, insan retinasında yaklaşık 92 milyon çubuk hücre vardır.[1] Çubuk hücreler, koni hücrelerden daha hassastır ve gece görüşünden neredeyse tamamen sorumludur. Bununla birlikte, çubuk hücrelerinin renk görmede çok az rolü vardır, bu da renklerin loş ışıkta daha az belirgin olmasından kaynaklanmaktadır.
| Çubuk hücreleri | |
|---|---|
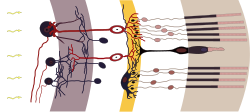
| |
| Retina kesiti. Çubuk hücreleri en sağda. | |
| Kaynak yapı | Retina |
Yapısı
değiştirÇubuklar, koni hücrelerinden biraz daha uzun ve daha incedir ancak aynı temel yapıya sahiptir. Opsin içeren diskler, hücrenin sonunda gözün iç kısmına bağlı olan retina pigment epiteline bitişiktir. Hücrenin dedektör kısmının istiflenmiş disk yapısı çok yüksek verim sağlamaktadır. Çubuklar, 6 ila 7 milyon koni hücresine kıyasla yaklaşık 120 milyon çubuk hücre ile konilerden çok daha fazladır.[2]
Koniler gibi, çubuk hücrelerin de sinaptik bir terminali, bir iç segmenti ve bir dış segmenti bulunmaktadır. Sinaptik terminal, genellikle bir bipolar hücre veya yatay bir hücre olan başka bir nöronla bir sinaps oluşturur. İç ve dış segmentler,[3] distal segmenti kaplayan bir siliyer ile bağlanmaktadır.[4] İç kısım, organelleri ve hücre çekirdeğini içerirken, gözün arkasına doğru işaret edilen çubuk dış segmenti, ışığı soğuran malzemeleri içermektedir.[3]
Bir insan çubuk hücresi yaklaşık 2 mikron çapında ve 100 mikron uzunluğundadır.[5] Çubukların tümü morfolojik olarak aynı değildir; farelerde, dış pleksiform sinaptik katmana yakın çubuklar, kısaltılmış bir sinaptik terminal nedeniyle azaltılmış bir uzunluk sergilemektedir.[6]
Fonksiyonları
değiştirFotoreseptörler
değiştirOmurgalılarda, bir fotoreseptör hücresinin aktivasyonu, hücrenin bir hiperpolarizasyonudur (inhibisyonudur). Karanlıkta olduğu gibi, uyarılmadıklarında, çubuk hücreler ve koni hücreleri depolarize olur ve kendiliğinden bir nörotransmitter salgılamaktadırlar. Bu nörotransmitter, bipolar hücreyi hiperpolarize eder. Bipolar hücreler, fotoreseptörler ve ganglion hücreleri arasında bulunur ve fotoreseptörlerden gangliyon hücrelerine sinyal iletmek için hareket etmektedir. Bipolar hücrenin hiperpolarize olması sonucunda, bipolar ganglion sinapsı vericisini serbest bırakmaz ve sinaps uyarılmaz.
Işıkla fotopigmentlerin aktivasyonu, çubuk hücreyi hiperpolarize ederek bir sinyal göndermektedir. Bu durum çubuk hücrenin nörotransmitterini göndermemesini sağlamaktadır. Bipolar hücre oluşur. Ardından vericisini bipolar ganglion sinapsında serbest bırakır ve sinapsı harekete geçirir.
Çubuk hücrelerin depolarizasyonu, nörotransmitterlerin salınımına neden olur. Çünkü karanlıkta hücreler, iyon kanallarını açan, büyük ölçüde sodyum kanalları, ancak kalsiyum içeri girebilse de, nispeten yüksek halkalı guanozin 3'-5' monofosfata (cGMP) sahiptir. Elektrokimyasal gradyanı boyunca hücreye giren iyonların pozitif yükleri hücrenin zar potansiyelini değiştirir, depolarizasyona neden olur ve nörotransmiter glutamat salınımına yol açmaktadır. Glutamat, bazı nöronları depolarize edebilir ve diğerlerini hiperpolarize ederek fotoreseptörlerin antagonistik bir şekilde etkileşime girmesine izin verebilir.
Işık, fotoreseptör hücre içindeki fotoreseptif pigmentlere çarptığında, pigment şekil değiştirir. Rodopsin (conopsin koni hücrelerinde bulunur) adı verilen pigment, opsin adı verilen plazma zarında yer alan büyük bir protein içermektedir. Buna kovalent olarak bağlı bir prostetik grup bağlanmaktadır: retinal adı verilen organik bir molekül (A vitamininin bir türevi). Retina, karanlıkta 11-cis-retinal formda bulunmaktadır ve ışıkla uyarım, yapısının all-trans-retinal olarak değişmesine neden olmaktadır. Bu yapısal değişiklik, transducin (bir tür G proteini) adı verilen düzenleyici bir protein için artan bir yakınlığa neden olmaktadır. Rodopsine bağlandıktan sonra, G proteininin alfa alt birimi, bir GDP molekülünün yerine bir GTP molekülü koyar ve aktive olur. Bu yer değiştirme, G proteininin alfa alt biriminin, G proteininin beta ve gama alt birimlerinden ayrılmasına neden olmaktadır. Sonuç olarak, alfa alt birimi artık cGMP fosfodiesteraza (bir efektör protein) bağlanmak için serbesttir.[8] Alfa alt birimi, inhibitör PDE gama alt birimleri ile etkileşime girer. Bunların PDE'nin alfa ve beta alt birimleri üzerindeki katalitik bölgeleri bloke etmelerini önlemektedir. cGMP'yi (ikinci haberci) hidrolize eden ve onu 5'-GMP olarak parçalayan cGMP fosfodiesterazın aktivasyonuna yol açmaktadır. cGMP'deki azalma, iyon kanallarının kapanmasına, pozitif iyonların akışının önlenmesine, hücrenin hiperpolarize edilmesine ve nörotransmiter glutamat salınımının durdurulmasına izin vermektedir. Koni hücreleri esas olarak nörotransmiter madde asetilkolini kullanmasına rağmen, çubuk hücreler çeşitli şekilde kullanmaktadır. Işığın duyusal bir tepkiyi başlattığı sürecin tamamına görsel fototransdüksiyon denilmektedir.
Çubuklardaki ışığa duyarlı pigment olan tek bir rodopsin biriminin aktivasyonu, sinyal güçlendirildiği için hücrede büyük bir reaksiyona yol açabilmektedir. Aktive edildiğinde, rodopsin yüzlerce transdusin molekülünü aktive edebilir ve bunların her biri sırayla saniyede binden fazla cGMP molekülünü parçalayabilen bir fosfodiesteraz molekülünü aktive eder. Bu nedenle, çubuklar az miktarda ışığa büyük bir tepki verebilir.
Rodopsinin retinal bileşeni A vitamininden türetildiği için, A vitamini eksikliği çubuk hücrelerin ihtiyaç duyduğu pigmentte bir eksikliğe neden olmaktadır. Sonuç olarak, daha az çubuk hücresi, daha karanlık koşullarda yeterince tepki verebilir ve koni hücreleri karanlıkta görmeye yetersiz şekilde adapte olduğundan, körlüğe neden olabilir. Buna gece körlüğü denir.
Dinlenme durumu
değiştirÇubuklar, bir ışık parlamasından sonra dinlenme durumuna hızlı bir şekilde geri dönmeyi sağlamak için üç engelleyici mekanizmadan (negatif geri besleme mekanizmaları) yararlanmaktadır.
İlk olarak, aktive edilmiş rodopsinin sitozolik kuyruğunu çoklu serinler üzerinde fosforile edecek, transdusinin aktivasyonunu kısmen inhibe edecek bir rodopsin kinaz (RK) bulunmaktadır. Ayrıca, bir inhibitör protein (arrestin) daha sonra rodopsin aktivitesini daha fazla inhibe etmek için fosforlanmış rodopsinlere bağlanmaktadır.
Tutuklama rodopsini kapatırken, bir RGS proteini (GTPaz aktive edici proteinler (GAP'ler) olarak işlev görür) bağlı GTP'nin GDP'ye hidroliz oranını artırarak transdusini (G-proteini) "kapalı" duruma getirir.
cGMP konsantrasyonu düştüğünde, önceden açık olan cGMP'ye duyarlı kanallar kapanır ve bu da kalsiyum iyonlarının akışında bir azalmaya yol açmaktadır. Kalsiyum iyonlarının konsantrasyonundaki ilişkili azalma, kalsiyum iyonuna duyarlı proteinleri uyarmaktadır. Bu proteinler daha sonra cGMP'yi yenilemek için guanilil siklazı aktive eder ve onu hızla orijinal konsantrasyonuna geri getirmektedir. Bu, cGMP'ye duyarlı kanalları açar ve plazma zarının depolarizasyonuna neden olmaktadır.[9]
Duyarsızlaştırma
değiştirÇubuklar uzun süre yüksek konsantrasyonda fotonlara maruz kaldıklarında çevreye karşı duyarsızlaşırlar.
Rodopsin, rodopsin kinaz (GPCR kinazlarının (GRK'ler) bir üyesi) tarafından fosforile edildiğinden, yüksek afinite ile arrestine bağlanmaktadır. Bağlı tutuklama, duyarsızlaştırma sürecine en az iki şekilde katkıda bulunabilir. İlk olarak, G proteini ile aktive edilmiş reseptör arasındaki etkileşimi engellemektedir. İkincisi, reseptöre klatrin bağımlı endositoz makinesine yardımcı olmak için bir adaptör protein olarak hizmet etmektedir.[9]
Duyarlılık
değiştirBir çubuk hücre, tek bir ışık fotonuna tepki verecek kadar hassastır ve tek bir fotona konilerden yaklaşık 100 kat daha duyarlıdır.[10] Çubuklar, konilerden daha az ışık gerektirdiğinden, geceleri birincil görsel bilgi kaynağıdır. Koni hücreleri ise aktive olmak için onlarca ila yüzlerce foton gerektirir. Ek olarak, birden fazla çubuk hücre, sinyalleri toplayarak ve yükselterek tek bir ara nöron üzerinde birleşmektedir. Bununla birlikte, bu yakınsama görme keskinliğine (veya görüntü çözünürlüğüne) bağlıdır. Çünkü birden fazla hücreden toplanan bilgi, görsel sistemin her bir çubuk hücreden ayrı ayrı bilgi alması durumunda olacağından daha az farklıdır.
Çubuk hücreler ayrıca ışığa konilerden daha yavaş tepki verir ve aldıkları uyaranlar kabaca 100 milisaniyede işlenmektedir. Bu, çubukları daha küçük miktarlardaki ışığa karşı daha duyarlı hale getirirken, aynı zamanda, hızlı değişen görüntüler gibi zamansal değişiklikleri algılama yeteneklerinin, konilerden daha az doğru olduğu anlamına gelmektedir.[3]
George Wald ve diğerleri tarafından yapılan deneyler, çubukların en çok 498 nm (yeşil-mavi) civarındaki ışığın dalga boylarına duyarlı olduğunu ve yaklaşık 640 nm'den (kırmızı) daha uzun dalga boylarına karşı duyarsız olduğunu göstermiştir. Bu Purkinje etkisinden kaynaklanmaktadır: alacakaranlıkta yoğunluk azaldıkça, çubuklar devreye girer ve renk tamamen kaybolmadan önce, görmenin tepe duyarlılığı çubukların tepe duyarlılığına (mavi-yeşil) doğru kaymaktadır.[12]
Kaynakça
değiştir- ^ Curcio, C. A.; Sloan, K. R. (1990). "Human photoreceptor topography". The Journal of Comparative Neurology. 292 (4): 497-523. doi:10.1002/cne.902920402. PMID 2324310.
- ^ "The Rods and Cones of the Human Eye". hyperphysics.phy-astr.gsu.edu. 28 Ekim 2000 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Nisan 2016.
- ^ a b c Kandel E.R., Schwartz, J.H., Jessell, T.M. (2000). Principles of Neural Science, 4th ed., pp. 507–513. McGraw-Hill, New York.
- ^ "Photoreception" McGraw-Hill Encyclopedia of Science & Technology, vol. 13, p. 460, 2007
- ^ "How Big Is a Photoreceptor". Cell Biology By The Numbers. Ron Milo & Rob Philips. 8 Ekim 2014 tarihinde kaynağından arşivlendi.
- ^ Li, Shuai; Mitchell, Joe; Briggs, Deidrie J.; Young, Jaime K.; Long, Samuel S.; Fuerst, Peter G. (1 Mart 2016). "Morphological Diversity of the Rod Spherule: A Study of Serially Reconstructed Electron Micrographs". PLOS ONE. 11 (3): e0150024. Bibcode:2016PLoSO..1150024L. doi:10.1371/journal.pone.0150024. PMC 4773090 $2. PMID 26930660. 21 Şubat 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Ocak 2017 – PLoS Journals vasıtasıyla.
- ^ Human Physiology and Mechanisms of Disease by Arthur C. Guyton (1992) p. 373
- ^ "G Proteins". rcn.com. 19 Eylül 2002 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Ocak 2017.
- ^ a b Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter (2008). Molecular Biology of The Cell, 5th ed., pp.919-921. Garland Science.
- ^ Okawa, Haruhisa; Alapakkam P. Sampath (2007). "Optimization of Single-Photon Response Transmission at the Rod-to-Rod Bipolar Synapse". Physiology. Int. Union Physiol. Sci./Am. Physiol. Soc. 22 (4): 279-286. doi:10.1152/physiol.00007.2007. PMID 17699881.
- ^ Bowmaker J.K. and Dartnall H.J.A. (1980). "Visual pigments of rods and cones in a human retina". J. Physiol. 298: 501-511. doi:10.1113/jphysiol.1980.sp013097. PMC 1279132 $2. PMID 7359434.
- ^ Wald, George (1937b). "Photo-labile pigments of the chicken retina". Nature. 140 (3543): 545. Bibcode:1937Natur.140..545W. doi:10.1038/140545a0.